
产品分类
PRODUCT CLASSIFICATION 更新时间:2025-10-30
更新时间:2025-10-30  浏览次数:245
浏览次数:245在皮肤科外用制剂与护肤品的研发进程中,药物经皮渗透数据的准确性至关重要,它直接关系到产品的药效与安全性评估。为获得更接近实际使用情况的数据,使用人体皮肤进行试验更为理想。然而,在实际研究中,新鲜人体皮肤的获取往往面临诸多困难,冷冻保存成为皮肤样本储存的常规操作。但冷冻-解冻过程是否会影响皮肤的屏障功能与药物渗透特性,一直是行业内争论的焦点。
近期来自北里大学的Miki Wada研究团队发表于《Journal of Society of Cosmetic Chemists of Japan》的一项研究为这一争议提供了新的证据。来自北里大学和 Mandom 公司的研究团队以手术切除后同一供体的新鲜眼睑皮肤为研究对象,系统比较了冷冻保存与未冷冻皮肤在药物渗透性、皮肤结构及酶活性等方面的差异,为外用制剂研发中的皮肤样本选择提供了重要参考。
皮肤作为人体最大的器官,其最外层的角质层是药物经皮渗透的主要屏障。角质层的细胞间脂质排列结构、完整性直接影响药物的渗透效率。在体外渗透试验中,皮肤样本的质量与保存条件是决定实验数据可靠性的关键因素。
目前,OECD 指南虽对皮肤吸收试验方法有明确规定,但未对皮肤保存条件作出详细说明。现实中,由于新鲜人体皮肤供应不稳定且难以即时使用,研究者普遍采用冷冻保存(通常 - 80℃)的方式延长皮肤样本的使用期限。然而,既往研究因动物种属、冷冻温度、保存时长等变量差异,得出的结论存在显著分歧:部分研究认为冷冻会破坏皮肤结构导致渗透性增加,另一些研究则表明短期冷冻对皮肤屏障功能无显著影响。
这种争议给外用制剂研发带来了困扰:使用低温冷冻保存的皮肤获得的渗透数据是否能真实反映新鲜皮肤的生理状态?不同保存条件下的实验结果是否具有可比性?为解决这些问题,本研究采用同一来源供体的眼睑皮肤,在严格控制变量的前提下,开展了冷冻与未冷冻皮肤的对比研究。
研究团队选择了面部(眼睑)皮肤作为研究对象,试验所用皮肤为北里大学医院整形外科提供的手术剩余皮肤。本研究经北里大学内部伦理委员会审查批准,并在获得受试者知情同意后实施。这个皮肤部位的选择具有重要的实际意义。与常用的腹部皮肤或动物皮肤相比,眼睑皮肤更接近外用药物与化妆品的实际应用部位,且角质层较薄、屏障功能特性独特,实验结果更具参考价值。
实验设置了两组对比样本:
• 未冷冻组:皮肤样本在 5℃条件下用 PBS 湿润的纱布保存,保存时长 1 - 4 天;
• 冷冻组:皮肤样本经橄榄油包裹后置于- 80℃冷冻保存,保存时长 1 - 4 天,使用前解冻。
这种设计排除了供体个体差异、保存时长等干扰因素,聚焦于冷冻 - 解冻过程本身对皮肤的影响。
研究选用两种理化性质差异显著的药物作为对象:
• 水溶性药物:咖啡碱(CAF,CAS No. 58-08-2,MW=194.2,logP=-0.1),常用于经皮渗透研究的模型化合物;
• 油溶性药物:异丙基酚(IPMP,CAS No.3228-02-2, MW=150.2,logP=3.37),广泛应用于外用制剂抗菌类化合物。
通过两种药物的对比,可全面评估皮肤保存条件对不同极性药物渗透的影响。
为深入探究冷冻对皮肤的影响机制,研究设置了6个维度的检测指标:
1. 药物渗透量:采用 Franz 扩散池法,测定 1 - 24 小时内两种药物的累积透皮量;
2. 皮肤内药物残留:通过分层取样,分析渗透 24 小时后表皮、真皮中的药物残留浓度;
3. 角质层药物分布:采用AST-01皮肤剥离胶带(ASCH Japan)结合 HPLC 检测,评估咖啡碱在角质层不同深度的分布;通过Labodorf 850C皮肤角质量测试仪对每个样品的角质进行定量,更准确反映模式药物在角质层中的相对含量,消除不同皮肤样本角质层总量差异对实验结果的干扰。

(Labodorf 850C皮肤角质量测试仪)
4. 屏障功能评估:通过VAPOSCAN AS-VT100经皮水分流失测量仪(ASCH Japan)测试反映皮肤整体屏障功能。

VAPOSCAN AS-VT100经皮水分流失测量仪(ASCH Japan)
5. 脂质结构分析:利用共聚焦 Raman光谱技术,解析角质层细胞间脂质的排列有序性;
6. 酶活性检测:测定酯酶活性,评估皮肤生化功能的完整性。
实验结果显示,两种药物在冷冻皮肤中的累积渗透量均显著高于未冷冻皮肤。对于咖啡碱,在 4、6、8 小时三个时间点,冷冻皮肤的渗透量显著更高;对于异丙基酚,这一差异在 6、8、24 小时更为明显。这一结果表明,冷冻 - 解冻过程会导致皮肤对水溶性和油溶性药物的渗透性普遍增强,且这种增强效应随时间推移更加显著。
这一发现对制剂研发具有参考意义:若采用冷冻皮肤进行渗透试验,可能会高估药物的实际渗透效率,尤其是对于需要长期评估的制剂。
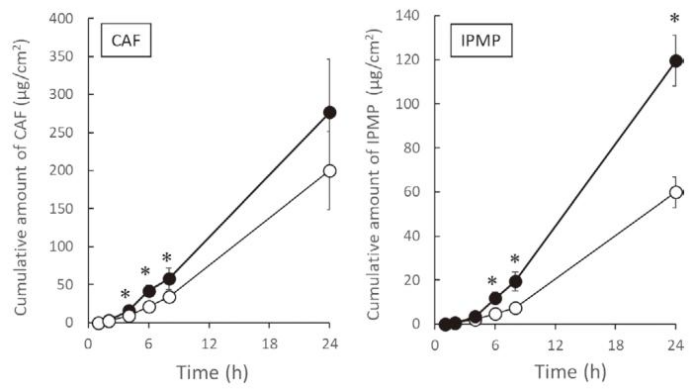
随时间推移,冷冻及新鲜皮肤中 CAF 和 IPMP 的累积量。所示数值为 11 - 14 个皮肤样本的平均值(●:冷冻皮肤,○:新鲜皮肤,*t 检验:p < 0.05)。
渗透试验 24 小时后,皮肤各层的药物残留分析揭示了更细微的差异:
• 表皮中,未冷冻皮肤的咖啡碱残留量显著高于冷冻皮肤,而异丙基酚的残留量无显著差异;
• 真皮中,两种药物在两组皮肤中的残留量均无显著差异。
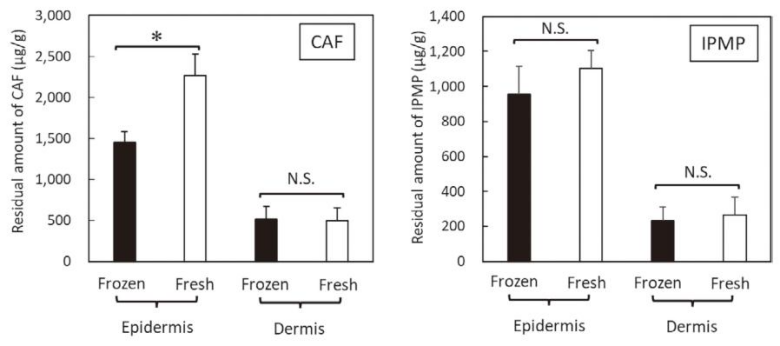
渗透测试24小时后,表皮/真皮中CAF/IPMP的残留量。CAF/IPMP的量通过皮肤重量进行了归一化处理。所示数值为6 - 8个皮肤样本的平均值。t检验:p < 0.05。
进一步的角质层分层研究显示,未冷冻皮肤的角质层各深度(1-5 层至16-20 层)咖啡碱残留量均高于冷冻皮肤。且未冷冻皮肤的咖啡碱残留量随角质层深度增加而逐渐降低,符合正常的药物渗透梯度;而冷冻皮肤的咖啡碱残留量在各深度分布较为均匀,提示角质层的屏障梯度可能已被破坏。
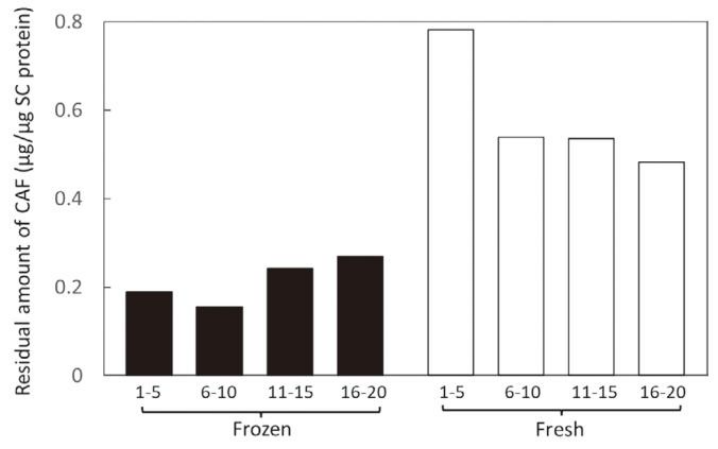
6小时渗透测试后角质层中CAF的残留量。该数值显示了五个剥离胶带总和的CAF含量。CAF含量通过角质层蛋白量进行了归一化处理。展示了两个皮肤样本的平均值。
这些结果表明,冷冻可能通过改变角质层的药物滞留能力,影响药物的经皮转运过程。水溶性药物受冷冻影响更为明显,可能与角质层脂质结构对水溶性物质的阻滞作用更易受物理损伤有关。
共聚焦 Raman 光谱分析为冷冻影响皮肤屏障功能提供了直接证据。角质层细胞间脂质的有序性可通过特征峰强度比I1080/(I1060+I1130)评估,该比值越低,脂质排列越有序。
结果显示,在角质层表面(0 - 2μm),两组皮肤的脂质有序性无显著差异;但在中深层(4 - 16μm),冷冻皮肤的特征峰比值显著高于未冷冻皮肤,表明其脂质结构有序性降低、出现明显紊乱。这种结构破坏可能是导致药物渗透性增加的原因:脂质排列紊乱使药物更容易通过细胞间隙扩散。
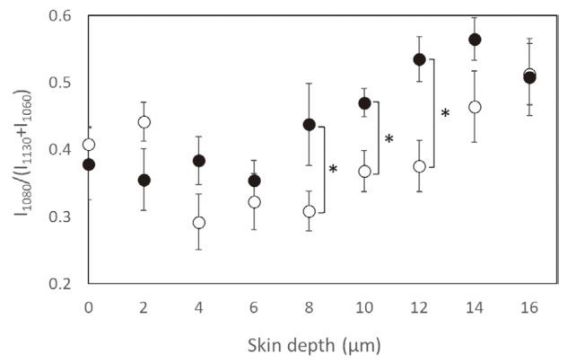
利用峰强度比I1080/(I1060+I1130)通过拉曼散射测定的角质层细胞间脂质结构的深度分布。所示数值为6-8个测定点的平均值(●:冷冻皮肤,○:新鲜皮肤,t检验:p < 0.05)。
值得注意的是,经皮水分流失量(TEWL)测定未发现两组皮肤的显著差异。这提示 TEWL 作为整体屏障功能的评估指标,可能无法灵敏捕捉角质层局部结构的细微变化,而 Raman 光谱等微观结构分析技术更具优势。
皮肤中的酯酶活性是评估皮肤生化功能的重要指标,与药物的代谢转化密切相关。实验结果显示,冷冻与未冷冻皮肤的酯酶活性无显著差异,表明冷冻 - 解冻过程未对皮肤的酶促反应能力未造成明显影响。
这一发现具有积极意义:对于需要考虑皮肤代谢因素的渗透研究,冷冻皮肤可在一定程度上保留酶活性,其代谢相关数据仍具有参考价值。
本研究明确证实,皮肤保存条件会显著影响药物渗透数据。因此,在外用制剂研发的体外渗透试验中,应严格统一皮肤样本的保存条件:
• 若需比较不同配方的渗透效率,所有实验必须使用相同保存状态(均冷冻或均未冷冻)的皮肤;
• 研究报告中应详细注明皮肤的来源、保存温度、保存时长及解冻方法,确保实验结果的可重复性与可比性。
研究显示,水溶性药物与油溶性药物受冷冻的影响程度存在差异。在实际研发中:
• 对于水溶性成分占主导的制剂(如保湿类护肤品、水溶性抗生素软膏),需特别关注冷冻对渗透数据的高估风险;
• 对于油溶性成分制剂,虽冷冻影响相对较小,但仍需谨慎解读实验结果,必要时结合新鲜皮肤数据进行验证。
基于研究结果,可对现有皮肤处理方法进行优化:
• 短期保存(1 - 4 天)可优先选择 5℃冷藏而非冷冻,以更好地保留皮肤的天然屏障特性;
• 若必须冷冻保存,建议采用橄榄油等保护剂减少冰晶形成对脂质结构的损伤;
• 在渗透试验中引入 Raman 光谱等结构分析技术,结合传统渗透数据,更全面评估皮肤样本质量。
目前 OECD 等指南对皮肤保存条件的模糊规定是导致实验结果差异的重要原因。本研究结果支持在相关指南中加入更明确的皮肤保存规范,如推荐保存温度、最长保存时长、质量验证方法等,促进行业研究数据的标准化与可比性。
尽管本研究设计严谨,但仍存在一定局限性:样本量较小且仅使用眼睑皮肤,不同部位(如腹部、背部)皮肤的冷冻响应可能存在差异;保存时长限定在 1 - 4 天,长期冷冻(如数月)的影响尚未评估;未深入探究冷冻导致脂质结构紊乱的分子机制。
未来研究可从以下方向展开:
• 扩大样本来源,比较不同部位皮肤对冷冻的响应差异;
• 延长观察周期,研究长期冷冻对皮肤结构与功能的影响;
• 结合小角 X 射线散射等技术,更精细地解析冷冻对脂质层状结构的影响;
• 探索优化的冷冻保护剂配方,减少冷冻对皮肤屏障功能的损伤。
皮肤保存条件对药物渗透性的影响长期以来存在争议,本研究通过一系列实验发现冷冻 - 解冻过程会通过破坏角质层细胞间脂质的有序结构,增加皮肤对水溶性和油溶性药物的渗透性,且对药物在皮肤内的分布产生显著影响。
这些发现对外用制剂研发具有指导价值,提醒研究者在实验设计中充分考虑皮肤保存条件的影响,通过标准化操作与检测技术的结合,提高渗透数据的可靠性。随着研究的深入与行业标准的完善,未来的外用制剂研发将更加精准、高效,为患者提供更安全有效的产品。
参考文献
1)A. M. Barbero, H. F. Frasch, Skin Pharmacol. Physiol., 29,31─40(2016)
2)J. B. Nielsen, I. Plasencia, J. A. Sørensen, L. A. Bagatolli,Skin Pharmacol. Physiol., 24, 93─102(2011)
3)B. Finnin, K. A. Walters, T. J. Franz, Topical and Transdermal Drug Delivery: Principles and Practice, Chapter 5, John Wiley & Sons, Inc., Hoboken, 2011, p. 85─108
4)Miki Wada, Kazuhiro Shiga, Toshihiro Mori, Katsunori Yoshida, The Effect of Skin Storage Conditions on Drug Permeability, Journal of Society of Cosmetic Chemists of Japan, 2025, Volume 59, Issue 2, Pages 81-87
CONTACT
办公地址:上海市嘉定区静塘路988号TEL:021-59169693
EMAIL:info@labcan.cn 微信公众号
微信公众号